产品货号:
YTC0663
中文名称:
B27无血清添加剂(无维生素A)
英文名称:
B27 Supplement(50X, Minus Vitamin A)
产品规格:
10mL|50mL
发货周期:
1~3天
产品价格:
询价
B27无血清添加剂(无维生素A)是一种经优化的、在完整B27 Supplement的基础上去除维生素A的神经干细胞培养添加剂,可广泛用于支持海马及其它中枢神经系统(CNS)神经干细胞的生长,维持其短期或长期生存活性。B27无血清添加剂(无维生素A)是培养神经祖细胞和神经干细胞的理想选择,无论是悬浮培养还是单层贴壁培养都不会诱导神经细胞的分化,在研究神经发育/分化及干细胞在遗传/退行性疾病替代疗法中的作用方面具有广泛应用。
B27无血清添加剂(无维生素A)以50×液体形式提供,可与Neurobasal、Neurobasal-A、DMEM/F12或DMEM(低糖)培养基配合使用进行神经干细胞的正常培养、生长,无需星形胶质细胞滋养层。
B27无血清添加剂(无维生素A)经严格的质量控制和过滤除菌处理,不含血清,由参与神经干存活、突触成熟、神经突起延伸的高品质抗氧化剂、多种细胞因子等组分配制而成,不含维生素A,具有极高品质,可实现高效培养多种类型的神经干细胞,并在长期培养条件下提高神经干细胞的生存活性。

- 用于中枢神经系统(CNS)、周围神经系统(PNS)、胚胎/成体神经干细胞(NSC)或神经前体细胞的无血清生长和活力维持;
- 神经细胞基础培养基的添加剂;
- 干细胞增殖与分化;
- 维持神经细胞来源的肿瘤细胞系活性;
- 优化产前和胚胎神经干细胞的活性和长期存活率;
- 扩增来自小鼠胚胎纹状体和中脑的EGF响应性前体细胞;
- 胚胎干细胞分化为神经元谱系(神经元和星形胶质细胞);
- 胚胎大鼠纹状体、黑质、鼻中隔和皮质以及新生儿小脑(胎儿和成人)神经干细胞的存活;
- 添加β-FGF后可用于皮质神经干细胞的生长和维持。

| 组分 | 10mL | 50mL |
| B27无血清添加剂(无维生素A) | 10mL | 50mL |
| 说明书 | 1份 | 1份 |
保存:-20℃,有效期2年。

- 本制品已经过滤除菌处理,使用时应注意无菌操作,避免污染。
- 如果发现本制品出现浑浊、沉淀等现象,则不能继续使用,同时请检查使用或保存时是否有环节造成污染,后续请注意避免。
- 根据实验需求,建议对本制品进行适量分装冻存,避免反复冻融,以免影响使用效果。
- 本制品不含维生素A,如果额外添加维生素A,其使用效果与B27无血清添加剂一致。
- L-Ala-Gln与L-Gln可以向百奥莱博采购L-丙胺酰-谷氨酰胺、L-谷氨酰胺。
- 本制品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品。
- 为了您的安全和健康,请穿实验服并戴一次性手套操作。

B27无血清添加剂(无维生素A)用于培养原代神经元细胞的实验流程请参考图1。
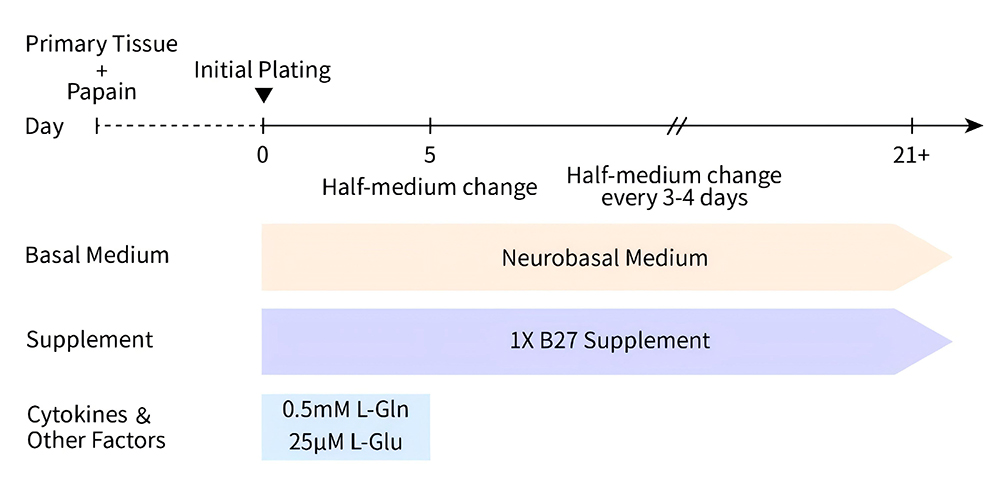
图1.B27无血清添加剂(无维生素A)用于培养原代神经元细胞的实验流程图。如图所示,建议在含有1×B27 Supplement及L-谷氨酰胺的Neurobasal培养基中添加终浓度为25μM的L-谷氨酸,用于原代神经元细胞的初始接种;培养4天后,需在不含L-谷氨酸的条件下进行培养基的更换和原代神经元细胞的长期培养。

- 完全培养基的配制
- 收到本制品后请立即按照说明书推荐的条件进行保存。使用时需将本制品放置于4℃解冻,并进行分装冻存,避免反复冻融影响神经干细胞生长和活力维持的效果。
- 参考下表,按比例配制完全培养基。
成分 用量 B27无血清添加剂(无维生素A) 2μL 200mM L-Gln/L-Ala-Gln 0.25μL Neurobasal Medium 97.75μL 总体积 100μL - B27无血清添加剂(无维生素A)与Neurobasal Medium配合使用,适用于产前和胚胎神经细胞的生长和活力维持;
B27无血清添加剂(无维生素A)与Neurobasal-A Medium配合使用,适用于新生和成年神经细胞的生长和活力维持;
B27无血清添加剂(无维生素A)与DMEM/F12配合使用,可用于支持中枢神经系统(CNS)、周围神经系统(PNS)、胚胎和成体神经干细胞(NSC)或神经前体细胞的无血清生长。 - 请根据实际需求配制相应体积的完全培养基,并尽快使用,或放置于2~8℃避光保存使用2~4周;剩余的完全培养基建议适当分装冻存于-20℃,后续随取随用,避免反复冻融。
- 用于原代海马神经元细胞初次接种时,需在完全培养基中额外添加终浓度为25μM的L-谷氨酸;培养至第4天,需使用不添加L-谷氨酸的完全培养基用于后续原代海马神经元细胞的生长培养和活力维持。
- 推荐使用百奥莱博的L-丙胺酰-谷氨酰胺或L-谷氨酰胺用于完全培养基的配制。
- 进行神经前体/干细胞(NSC)的培养过程中,除了需添加B27无血清添加剂(无维生素A),还需添加无菌的EGF和bFGF,以防止NSC的自发分化。建议使用含0.1% BSA的PBS溶液将生长因子配制成浓度为500μg/mL的储存液,并按需分装冻存于-20℃,随取随用;使用前快速解冻,并按照终浓度10~20ng/mL加入到完全培养基中用于神经前体/干细胞(NSC)的培养。
- B27无血清添加剂(无维生素A)与Neurobasal Medium配合使用,适用于产前和胚胎神经细胞的生长和活力维持;
- 收到本制品后请立即按照说明书推荐的条件进行保存。使用时需将本制品放置于4℃解冻,并进行分装冻存,避免反复冻融影响神经干细胞生长和活力维持的效果。
- 神经干细胞(NSC)的分离和培养
请参考以下步骤从E14-18 (妊娠第14~18天)的大鼠胚胎皮层、纹状体、中脑、丘脑、脊髓或海马组织中分离神经干细胞(NSC)。- 在无菌条件下,将所需区域的胚胎CNS或PNS组织收集到装有冷的不含钙和镁离子的Hanks平衡盐溶液(HBSS)的无菌10cm2培养皿中。
- 推荐使用百奥莱博的HBSS(含钙镁)及GoldBalb系列细胞培养皿。
- 使用新的无菌硅化玻璃巴斯德移液管将每个组织分别转移到含有3mL生长培养基的无菌15mL离心管中。
- 轻轻研磨组织20~30次,直至悬浮液浑浊并只剩下非常小的碎片,以使组织充分解离。随后将试管直立放置1分钟,让碎片缓慢沉降至离心管底部。
- 请勿用力或快速研磨,以免起泡或损伤神经干细胞。
- 使用新的无菌硅化玻璃巴斯德移液器,将悬浮液转移到新的无菌15mL离心管中。
- 请不要吸取和转移已沉降到管底部的未解离碎片。
- 将细胞悬浮液100×g,离心10分钟,弃去上清液,随后轻弹管底部以分散沉淀中的细胞。
- 将细胞重悬于1~2mL经预热的完全培养基中,并吸取少量细胞重悬液用细胞计数仪测定活细胞的数量和密度。
- 使用预热的完全培养基,按照2.5~5×104个活细胞/cm2 (单层贴壁培养)或1×105个活细胞/ml(悬浮培养)的密度接种细胞。
- 在无菌条件下,将所需区域的胚胎CNS或PNS组织收集到装有冷的不含钙和镁离子的Hanks平衡盐溶液(HBSS)的无菌10cm2培养皿中。
- 单层贴壁培养
- 使用经预冷、无菌且终浓度为0.015mg/mL的poly-D-lysine对培养表面(细胞培养级的玻璃片或培养皿表面)在37℃下放置过夜进行包被。
- 去除多聚赖氨酸溶液,并用无菌的且不含钙或镁离子的无菌D-PBS溶液反复冲洗两次,尽可能去除残留的多聚赖氨酸溶液。
- 由于多聚赖氨酸对细胞具有一定毒性,因此需彻底去除。
- 每次洗涤可在37℃条件下孵育20分钟。
- 将溶解于不含钙或镁离子的无菌D-PBS溶液溶液中的1mg/mL的纤连蛋白加入到培养表面,并放置于37℃孵育1~24小时。
- 吸出纤连蛋白溶液,用不含钙或镁离子的无菌D-PBS溶液洗涤一次。
- 培养皿可与不含钙或镁离子的无菌D-PBS溶液一起在37℃储存4天;使用前需用完全培养基冲洗培养表面。
- 根据标准实验室操作流程从胚胎14~18天的大鼠中分离神经干细胞。
- 将配制好的完全培养基放置于37℃进行预热,并按照实验目的接种所需密度的神经干细胞。
- 建议按照2.5~5×104个活细胞/cm2的密度接种细胞;或自行优化细胞接种密度。
- 将接种了细胞的培养皿放置于37℃,5% CO2的培养箱中培养。
- 当细胞培养覆盖度达到50~70%时需进行细胞传代。
- 用细胞铲(cell lifter)轻轻刮下细胞,并将细胞转移到无菌离心管中,进行100×g离心10分钟,弃去上清。
- 推荐使用无菌细胞铲进行培养表面细胞的刮取。
- 使用1~2mL经37℃预热的完全培养基将细胞沉淀轻轻重悬,并吸取少量细胞重悬液用细胞计数仪测定活细胞的数量和密度。
- 使用预热的完全培养基,按照合适的密度接种细胞,并将接种了细胞的培养皿放置于37℃,5% CO2的培养箱中培养。
- 使用经预冷、无菌且终浓度为0.015mg/mL的poly-D-lysine对培养表面(细胞培养级的玻璃片或培养皿表面)在37℃下放置过夜进行包被。
- 神经球悬浮培养
- 当悬浮培养2~6天,神经球直径达到约100μm时,收集神经球并将其转移到新的无菌离心管中。
- 将收集的细胞液进行100×g,离心10分钟,弃去上清液。
- 将神经球重悬于1mL新鲜预热的完全培养基中,并使用小口径吸头移液器轻轻反复吹打重悬液,以使神经球机械解离。
- 请勿用力或快速吹打,以免起泡或损伤神经球。
- 吸取少量细胞重悬液用细胞计数仪测定神经球的数量和密度。
- 使用新鲜预热的完全培养基,按照1×105个活细胞/ml的密度进行细胞接种。
- 将接种的细胞放置于37℃,5% CO2的恒温摇床中培养。
- 当悬浮培养2~6天,神经球直径达到约100μm时,收集神经球并将其转移到新的无菌离心管中。
- 神经干细胞(NSC)的分化
使用去除生长因子、添加了完整B27无血清添加剂和200mM L-Gln/L-Ala-Gln的Neurobasal培养基,替换上述连续培养所用的完全培养基,并将神经干细胞接种到强粘附基质的培养表面,可实现神经干细胞到神经元的自发分化。

- 几种配方的B27无血清添加剂有什么区别?
- B27无血清添加剂是用于多种类型神经元细胞长期生长和活性维持的完整配方;
- B27无血清添加剂(无抗氧化剂)去除了抗氧化剂成分,是用于研究氧化损伤,细胞凋亡,神经元自由基损伤的首要选择;
- B27无血清添加剂(无胰岛素)去除了胰岛素,是用于支持在额外添加胰岛素的情况下对海马和其他CNS神经元生长状态的研究;
- B27无血清添加剂(无维生素A)去除了诱导神经元细胞分化的维生素A,是用于神经干细胞生长和增殖的理想选择。
- B27无血清添加剂是用于多种类型神经元细胞长期生长和活性维持的完整配方;
- B27无血清添加剂与N-2无血清添加剂有什么区别?
B27添加剂主要用于神经干细胞及各类型神经元细胞的生长和活性维持;N-2添加剂主要用于培养神经母细胞瘤或来自PNS/CNS的有丝分裂后的神经元细胞。且与ITS或N-2添加剂相比,B27无血清添加剂(无维生素A)可促进神经前体/干细胞(NSC)的生长,并替代ITS和N-2添加剂用于将ES细胞分化为巢蛋白阳性神经前体细胞(的培养。 - 添加了B27添加剂的神经元细胞培养基,可保存多久?
由于B27添加剂中含有多种细胞因子及抗氧化剂等成分,因此将B27添加到培养基中后,需尽快在2~4周内使用,否则会影响B27添加剂维持神经元细胞生长的效果。 - 可以在37℃水浴或者培养箱中解冻B27添加剂吗?
不建议在37℃条件下解冻B27添加剂,推荐使用2~8℃过夜或室温2小时解冻,以保证B27添加剂的最佳使用效果。
相关搜索:B27无血清添加剂(无维生素A),B27无血清添加剂,B27添加剂,神经干细胞分离,神经干细胞培养,单层贴壁培养,神经球悬浮培养,神经干细胞分化,NSC培养,B27 Supplement(50X, Minus Vitamin A)



